预制前体纤维(PFFs)背景介绍
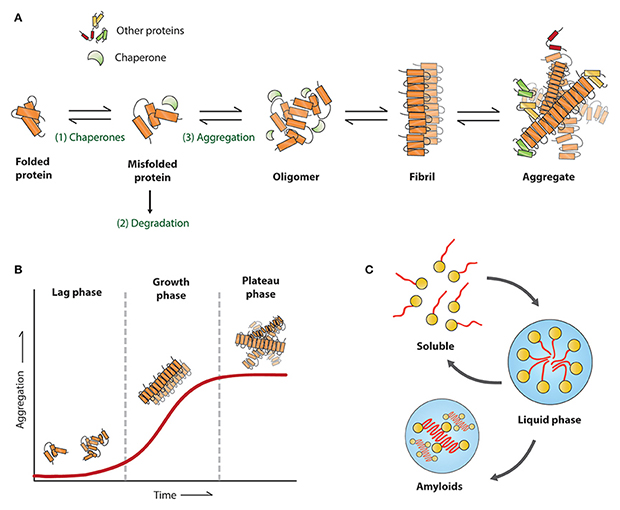 蛋白错误折叠和聚集示意图
蛋白错误折叠和聚集示意图
蛋白质聚集是阿尔兹海默病(AD)、帕金森病(PD)、肌萎缩侧索硬化症(ALS)以及亨廷顿舞蹈症(HD)等神经退行性疾病的主要病理特征。在病理状态下,Tau、Amyloid beta、alpha-synuclein、TDP-43、Huntingtin等蛋白发生构象改变,进而聚集形成具有传播能力的“种子”,诱发细胞内源性蛋白错误折叠和聚集,并通过细胞间传递的方式在神经元间传播,蛋白聚集体持续向纤维原和不溶性纤维的形态发展,最终形成蛋白沉淀和缠结。预制前体纤维(pre-formed fibrils,PFFs),即在体外预先制备,具有这类 “种子”活性、能够持续招募可溶性病理蛋白形成聚集体的纤维样蛋白。
建立细胞和动物等退行性疾病模型在发现潜在的致病机理和疾病分子机制、评估治疗干预措施的潜在疗效、初步评估候选药物分子的安全性中起到重要作用。相比于传统的疾病造模方式,PFFs诱导的病理发生不依赖于基因编辑,也不依赖于化学或物理损伤,可以更好的模拟自然发生的病理状态和病理进程,因此,PFFs是具有潜力的新型疾病造模工具。
预制前体纤维(PFFs)的制备和验证
PFFs可采用室温振摇的方式制备,或用一定浓度肝素诱导单体病理蛋白得到。PFFs的质量控制和使用前的准备对实验成功至关重要:成功制备PFFs关键在于使用高纯度、高浓度、构象正确的高质量单体蛋白;同时,由于PFFs的应用场景是细胞和动物实验,对内毒素的控制也是影响PFFs实验结果的重要因素;在使用PFFs之前,采用超声将PFFs处理成50 nm或更短的长度可以保证PFFs招募单体的活性,更利于细胞内吞PFFs。
PFFs的聚集形态和招募活性可以通过电子显微镜和硫黄素T(ThT)荧光检测法进行验证。利用电镜可以观察到PFFs不同长度的纤维结构;硫黄素T是检测β折叠结构的经典实验,原理是PFFs招募单体后形成β折叠结构,当ThT结合至β折叠结构时,致使荧光值升高,从而反映出PFFs招募单体的活性。
预制前体纤维(PFFs)产品
预制前体纤维(PFFs)产品列表
Aneuro作为ACROBiosystems百普赛斯专注于神经领域的品牌,可提供Tau-441 PFFs、alpha-synuclein PFFs、Amyloid beta PFFs、TDP-43 PFFs、SOD-1 PFFs等产品,助力打造神经退行性疾病模型。
更多PFFs正同步研发中,敬请期待~ 点击咨询
预制前体纤维(PFFs)产品优势
由高质量单体诱导:单体纯度及均一性经MALS验证≥90%,更利于PFFs的形成和保证诱导活性;
单体内毒素≤1.0 EU/μg,适合各类细胞和动物实验;
PFF的聚集形态和招募活性经电镜、ThT及细胞水平实验全面验证,分享protocol;
货期及批间更稳定,质控更严格,性价比更高;
提供更个性化的产品与服务,多种荧光标记方案可供定制选择:Star Staining 定点标记,Biotin标记,化学标记等,满足体内、体外实验不同需求。
预制前体纤维(PFFs)产品验证数据
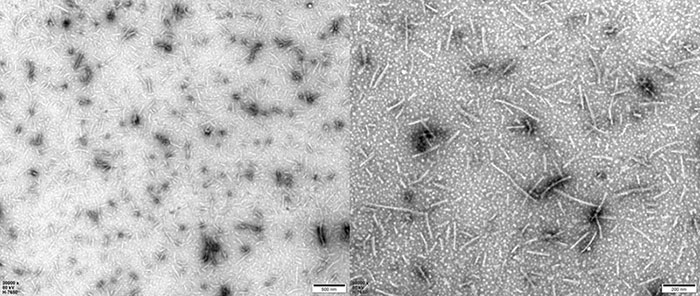
如下图所示,电镜下的PFFs具有明显的纤维结构,证明了我们的PFFs产品为聚集体。
TEM of Human Tau-441/2N4R Pre-formed Fibrils Protein (Cat. No. TAU-H5115).
TEM of Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein (Cat. No. TAU-H5113).
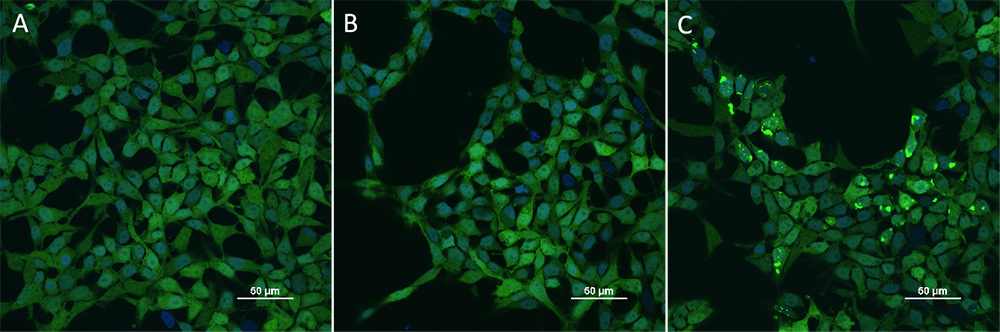
细胞实验验证PFFs的高诱导活性(验证结果与文献[3]基本一致)
共聚焦显微镜下观察到,经 Tau PFFs 诱导的HEK293/Human Tau-K18 (GFP) Stable Cell Line (Cat. No.
CHEK-ATP087) 中存在明显的 Tau 蛋白聚集。证明我们的Tau PFFs产品具有高诱导活性。
HEK293/Human Tau(GFP) Stable Cell Line were transduced with Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) (Cat. No. TAU-H5115) and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) (Cat. No. TAU-H5117) respectively. The fluorescence of GFP-Tau (Green) and DAPI (Blue) were detected by confocal microscope. A. Lipo2000 transduction. B. Lipo2000 and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) transduction. C. Lipo2000 and Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) transduction. Scale bars, 50 μm.
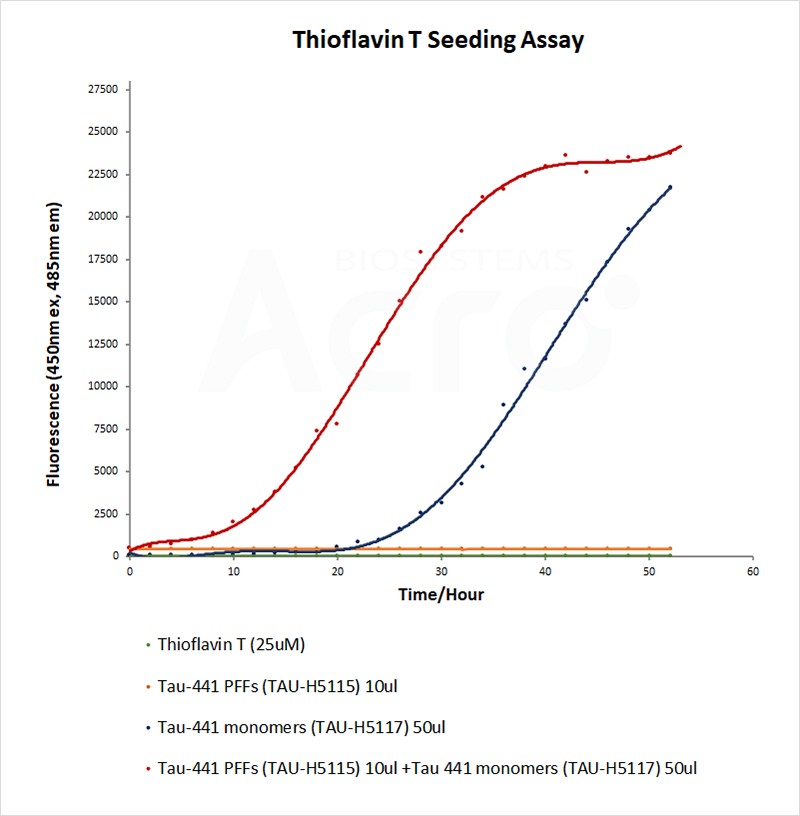
我们通过ThT荧光检测验证了PFFs具有招募单体聚合的能力:与只加入单体的实验组对比,加入PFFs更快地诱导了单体蛋白的聚合。
Thioflavin T emission curves show increased fluorescence (correlated to tau aggregation) over time when tau wild-type monomers (Cat. No. TAU-H5117) are combined with tau wild-type Pre-formed Fibrils (Cat. No. TAU-H5115).
申请 Protocol
Aggregation of Tau was visualized in organoids incubated with Tau PFFs, represented by the thickening of lines in red. Increasing concentration of PFFs resulted in a more noticeable aggregation of Tau.
With the addition of α-syn PFFs into the organoid model, swelling of axon microtubules and neuron density loss is visualized. In comparison to control, significant microtubule loss (thin green lines) suggests oxidative stress stemming from addition of PFFs.
参考文献
- 1. Stroo E, Koopman M, Nollen EA, Mata-Cabana A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci. 2017 Feb 14;11:64. doi: 10.3389/fnins.2017.00064. PMID: 28261044; PMCID: PMC5306383.
- 2. Guo JL, Lee VM. Seeding of normal Tau by pathological Tau conformers drives pathogenesis of Alzheimer-like tangles. J Biol Chem. 2011 Apr 29;286(17):15317-31. doi: 10.1074/jbc.M110.209296. Epub 2011 Mar 3. PMID: 21372138; PMCID: PMC3083182.
- 3. Sanders D W, Kaufman S K, DeVos S L, et al. Distinct tau prion strains propagate in cells and mice and define different tauopathies[J]. Neuron, 2014, 82(6): 1271-1288. doi: 10.1016/j.neuron.2014.04.047.

























 Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!
Star Ribbon预染蛋白Marker蛋白质标记物是生物研究和药物开发的重要组成部分。无论是用于蛋白质电泳还是western blot,我们的预染色蛋白质标记物帮助您快速确定目标蛋白质的分子量或评估转移效率。Fc受体蛋白治疗性抗体的功效取决于Fab片段及其对目标抗原的结合活性,还取决于Fc片段及其与关键Fc受体的相互作用。因此,在抗体工程中候选物必须针对一系列受体进行测试。探索我们的重组Fc受体蛋白质的全面收藏!




























 膜杰作
膜杰作 Star Staining
Star Staining